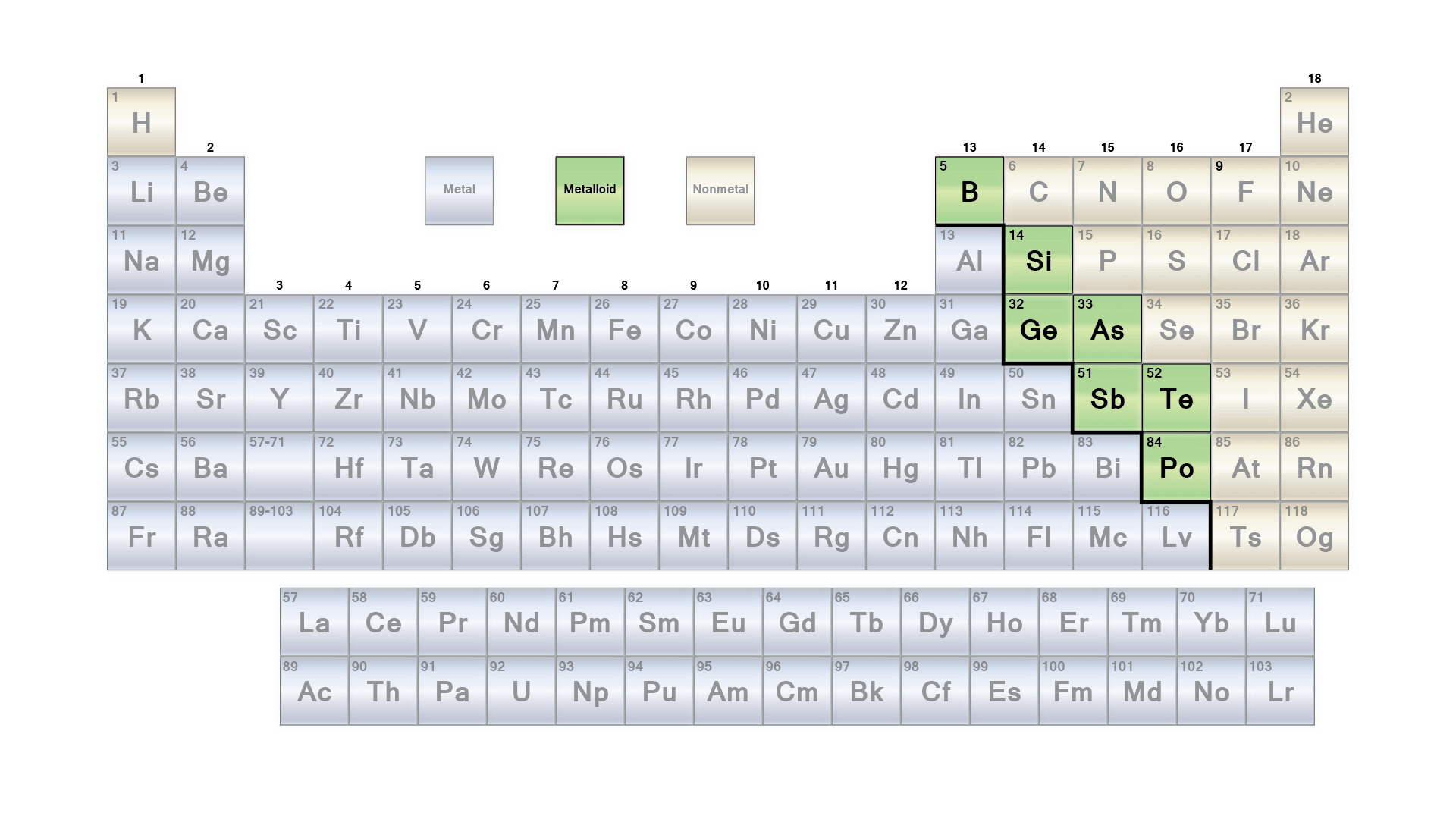
Les éléments sont classés en trois catégories. Ils comprennent les métaux, les métalloïdes et les non-métaux. Cette fois-ci, nous allons parler des métalloïdes. Ces éléments figurent dans le tableau périodique entre les non-métaux et les métaux. Communément appelés semi-métaux, les métalloïdes sont composés de neuf éléments clés, dont le bore, le silicium, le germanium, l’arsenic, l’antimoine, le tellure, l’astate, le bismuth et le polonium.
Les métalloïdes sont des éléments qui présentent certaines propriétés des métaux et d’autres des non-métaux. Ils ressemblent généralement à des métaux, à des fragiles et à des semi-conducteurs. Cet article aborde les différentes propriétés physiques et chimiques des métalloïdes. Nous décrirons également laquelle de leurs propriétés est la plus utile.
Faites défiler la page pour continuer à lire et en apprendre davantage !
Propriétés physiques des métalloïdes
A l’état solide à température ambiante
Tous les métalloïdes se trouvent à l’état solide à température ambiante. Les éléments métalloïdes ont un point de fusion élevé comme on peut le voir dans le tableau ci-dessous. (Le Tableau 1 montre le point de fusion de chaque élément métalloïde, du plus bas au plus élevé.)
| Éléments | Point de fusion |
| Tellure | 449,5°C |
| Antimoine | 631°C |
| Arsenic | 817°C |
| Germanium | 938,3°C |
| Silicium | 1410°C |
| Bore | 2079°C |
Apparence brillante métallique
Les métalloïdes ont généralement une brillance métallique. Ainsi, ils ont une apparence physique similaire à un métal. Dans leur forme pure, comme le silicium, ils peuvent avoir une brillance métallique. Pour cette raison, ces types d’éléments sont appelés métalloïdes. Vous pouvez voir ci-dessous les différentes apparences physiques de chaque métalloïde.
Ils sont cassants
Contrairement aux métaux, les métalloïdes sont généralement cassants et peuvent être facilement brisés. Ainsi, certaines techniques de formage utilisées pour les métaux, telles que le formage à froid, ne sont pas idéalement adaptées aux métalloïdes. Cette propriété limite les métalloïdes dans certaines applications.
Conductivité électrique intermédiaire
Comparés aux métaux, les métalloïdes ont une conductivité électrique intermédiaire. Cependant, ces éléments sont également de meilleurs conducteurs électriques par rapport aux non-métaux. Ces éléments, tels que le silicium, sont utilisés en tant que semi-conducteurs. Par conséquent, ils sont idéaux pour l’industrie électronique.
Densité
La densité des métalloïdes peut varier. Par exemple, le bore a une densité relativement faible, tandis que le tellure et le polonium sont plus denses.
Chemical Properties of Metalloids
Partage plusieurs caractéristiques avec les non-métaux
Il y a trois façons dont les métalloïdes se comportent comme les non-métaux, notamment:
Formation d’anions. Tout comme les non-métaux, les métalloïdes gagnent facilement des électrons pour devenir des anions.
Liaisons covalentes. Les métalloïdes forment souvent des liaisons covalentes lorsqu’ils réagissent avec d’autres non-métaux.
Multiple états d’oxydation. Les éléments appartenant aux métalloïdes peuvent varier le nombre d’électrons qu’ils gagnent ou perdent dans les réactions chimiques. Créant ainsi un composé avec un élément différent.
Énergie d’ionisation modérée
L’énergie d’ionisation fait référence à la quantité d’énergie nécessaire pour retirer un électron d’un atome ou d’un ion. Les métalloïdes ont généralement une énergie d’ionisation supérieure à celle des métaux mais inférieure à celle des non-métaux.
Électronegativités intermédiaires
L’électronegativité mesure la tendance d’un élément à attirer des électrons lors de la formation d’une liaison chimique. Les métalloïdes ont une électronegativité plus élevée que les métaux mais moins élevée que celle des non-métaux.
Connus comme amphiotères
Certains métalloïdes comme le bore sont connus pour avoir un comportement amphotère. Cela signifie qu’ils peuvent agir à la fois comme des acides et des bases dans les réactions chimiques, en fonction des conditions.
Différenciation et Propriétés les Plus Utiles des Métalloïdes
Les propriétés les plus distinctives de ces éléments sont qu’ils ont une combinaison de caractéristiques métalliques et non métalliques. Certains métalloïdes comme le silicium ont la capacité d’agir en tant que semi-conducteur. Cette caractéristique unique des métalloïdes en fait un élément important utilisé dans l’industrie électronique. Son comportement semi-conducteur peut être amélioré en utilisant la technique du dopage.
Identification des Métalloïdes à Travers Leurs Propriétés
Vous pouvez identifier un métalloïde à travers ses propriétés physiques facilement simplement en regardant son apparence. Cependant, il est plus difficile d’identifier les métalloïdes basés sur leurs propriétés chimiques car ils n’ont aucune caractéristique qui se distingue des métaux ou des non-métaux.
Conclusion
En résumé, nous avons appris les différentes propriétés physiques et chimiques des métalloïdes. Les métalloïdes sont naturellement solides et cassants. Ils ont également une brillance métallique, une conductivité électrique intermédiaire et une densité modérée en ce qui concerne leurs propriétés physiques. Les métalloïdes ont également une ionisation d’énergie intermédiaire, des électronégativités et un comportement amphotère intermédiaires en ce qui concerne leurs propriétés chimiques.
Questions Fréquemment Posées
Bore
Il s’agit d’un élément allotropique très dur. Il se caractérise également par sa forte résistance à la chaleur. Son numéro atomique dans le tableau périodique est 5.
Généralement utilisé pour fabriquer du verre résistant aux chocs thermiques avec du silicium.
Silicium
Cet élément a un aspect brillant et grisâtre et est connu pour ses propriétés semiconductrices. Il se caractérise également par ses points d’ébullition et de fusion élevés. Son numéro atomique dans le tableau périodique est 14.
Habituellement utilisé pour les semi-conducteurs.
Germanium
Le germanium est un élément cassant et dur. Il a un numéro atomique de 32 dans le tableau périodique.
Il n’est pas couramment utilisé comme semi-conducteur.
Arsenic
L’arsenic est un élément toxique caractérisé par son apparence grise acier. Son numéro atomique dans le tableau périodique est 33.
Il est couramment utilisé comme insecticide.
Tellure
Le tellure a un numéro atomique de 33 dans le tableau périodique. Ces éléments sont des chalcogènes lorsqu’ils sont utilisés en association avec le soufre et le sélénium. Il est également naturellement cassant.
Il est généralement utilisé comme additif à l’acier pour améliorer l’usinabilité.
Antimoine
L’antimoine est un métalloïde cassant et dur avec le numéro atomique 51 dans le tableau périodique. Ils sont généralement utilisés comme peintures colorées.
Tout comme les autres éléments, les métalloïdes sont également composés d’électrons, de neutrons et de protons.
| Métaux | Métalloïdes | Non-métaux |
| Solides à température ambiante | Solides à température ambiante | Solides à température ambiante |
| Ont un lustre métallique | Certains ont un lustre métallique | Mat |
| Malléables et ductiles | Cassants | Cassants |
| Haute conductivité électrique | Conductivité électrique intermédiaire | Faible conductivité électrique |
| Hautes densités | Densités modérées | Faibles densités |









